拼音名:Pishang Huahen Renyong Bushijun Huoyimiao
英文名:Brucellosis Vaccine(Live)for Percutaneous Scarification
书页号:2005年版三部-46
本品系用布氏菌的弱毒菌株经培养、收集菌体加入稳定剂后冻干制成。用于预防布氏菌病。
1 基本要求
生产和检定用设施、原料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2 制造
2.1 菌种
生产用菌种应符合“生物制品生产检定用菌毒种管理规程”的有关规定。
2.1.1 名称及来源
生产用菌种为牛布氏菌的弱毒菌株104M株。
2.1.2 种子批的建立
应符合“生物制品生产检定用菌毒种管理规程”的有关规定。
禁止使用通过动物传代后再分离之菌株制造疫苗。
2.1.3 种予批菌种的检定
2.1.3.1 培养特性
在含有1:50 000碱性品红培养基应生长,但在含同浓度的硫堇培养基应不生长(亦可用纸片法检查),在肝琼脂斜面培养基产生微量硫化氢。涂片镜检应为革兰阴性球杆菌。
2.1.3.2 变异检查
用生理氯化钠溶液将新鲜培养物制成含菌2.5×10〈9〉~3.0×10〈9〉/ml的菌悬液,置90℃水浴中30分钟,不应出现凝集现象。用同浓度的菌悬液与1:1000三胜黄素水溶液等量混合,于37℃放置24小时,不应出现凝集现象。用结晶紫菌落染色检查,菌落变异率不高于3%。
2.1.3.3 噬菌体裂解试验
将菌种接种于肝琼脂平皿,加入布氏菌Tb噬菌体1滴,于35~37℃培养44~48小时,噬菌体流过处应无本菌生长。
2.1.3.4 血清学试验
用生理氯化钠溶液将新鲜培养物制成含菌5.0×10〈9〉/ml的菌悬液,与布氏菌参考血清做凝集反应,其凝集效价应达到血清原效价。
2.1.3.5 残余毒力检查
用生理氯化钠溶液将35~37℃培养44~48小时之肝琼脂斜面新鲜培养物制成菌悬液,并稀释成含菌1.5×10〈9〉/ml、3.0×10〈9〉/ml、6.0×10〈9〉/ml、1.2×10〈10〉/ml和2.4×10〈10〉/ml等5个浓度的菌悬液。取体重18~20g小鼠25只分为5组,各组分别用不同浓度的菌悬液腹腔注射,每只0.5ml,观察7天,计算LD〈[50]〉,应含菌1.0×10〈9〉~2.0×l0〈9〉。
2.1.3.6 免疫力试验
每3~5年至少做一次免疫力试验。用生理氯化钠溶液将菌种第1代新鲜培养物制成2.0×10〈8〉/ml的菌悬液。取体重300~350g豚鼠10只,每只皮下注射lml,经25~30天后,每只豚鼠皮下攻击羊型强毒布氏菌10个或20个感染量(MID)。同时取3只豚鼠作对照,皮下注射1MID。免疫及对照豚鼠于注射毒菌悬液后均观察25~30天后解剖,取出鼠腹股沟淋巴结、腹主动脉旁淋巴结、肝及脾,分别接种肝琼脂中管斜面培养基,于35~37℃培养10天。如免疫动物组织之培养物有布氏菌生长,应用硫堇培养基(亦可用纸片法)和硫化氢反应做菌型鉴别试验。对照组3只豚鼠都必须发生全身感染,即肝脏或脾脏应分离出羊型毒菌。免疫组攻击10MID时,10只豚鼠中不应有2只以上分离出羊型毒菌;攻击20MID时,10只豚鼠中不应有3只以上分离出羊型毒菌。
2.1.4 种子批的保存
菌种应冻干,于2~8℃保存。
2.2 原液
2.2.1 生产用种子
2.2.1.1 将工作种子批菌种肩开后,接种在肝琼脂斜面或其他适宜培养基上,置35~37℃培养44~48小时为第1代。第1代菌种须进行1:500三胜黄素玻片凝集试验,只有光滑型菌方可用于疫苗生产。第1代菌种斜面于2~8℃可保存15日。
2.2.1.2 将第1代菌种接种到肝琼脂或其他适宜培养基上,置35~37℃培养44~48小时为第2代菌种,经肉眼纯菌检查合格后,弃去凝固水,用无菌生理氯化钠溶液制成菌悬液。即为生产用种子。
2.2.2 培养基
可采用pH6.6~7.2的琼脂或经批准的其他培养基。
2.2.3 菌种接种和培养
将第2代菌种接种2.2.2项培养基上,置35~37℃培养44~48小时,肉眼逐瓶检查,有杂菌者应废弃。
2.2.4 采集
用含有蔗糖、明胶、硫脲和味精的稳定剂或其他适宜的稳定剂洗下菌苔或刮取菌苔于稳定剂内。数瓶培养物可采人或刮入1瓶(或1大管)稳定液内,即为原液,置2~8℃保存。检定合格的原液可进行合并。
2.2.5 原液检定
按3.1项进行。
2.3 半成品
2.3.1 配制
将合并后的原液稀释成含菌1.8×10〈1l〉~2.0×10〈1l〉/ml,使每1次人用剂量含菌9.0×10〈9〉~10.0×10〈9〉。稀释后的原液经纯菌检查合格后即可分装冻干。由原液采集到冻干不得超过7天。
2.3.2 半成品检定
按3.2项进行。
2.4 成品
2.4.1 分批
应符合“生物制品分批规程”规定。
2.4.2 分装与冻干
应符合“生物制品分装和冻干规程”规定。分装后应立即进行冻干,真空封口,亦可充氮封口。
2.4.3 规格
每瓶10次人用剂量。每1次人用剂量含菌数为9.0×10〈9〉~10.0×10〈9〉。
2.4.4 包装
应符合“生物制品包装规程”规定。
3 检定
3.1 原液检定
纯菌检查
按附录ⅫA方法做纯菌检查,生长物做涂片镜检,不得有杂菌。
3.2 半成品检定
纯菌检查
按附录ⅫA方法做纯菌检查,生长物做涂片镜检,不得有杂菌。
3.3 成品检定
除水分测定外,按标示量加入氯化钠注射液,复溶后进行其余各项检定。
3.3.1 鉴别试验
用特异血清做凝集试验,应出现明显凝集反应,或按2.1.3.3项进行。
3.3.2 外观
应为乳白色疏松体。按标示量加入生理氯化钠溶液后应于1分钟内复溶,并呈均匀悬液。
3.3.3 水分
应不高于3.0%(附录ⅦD)。
3.3.4 纯菌检查
按附录ⅫA方法做纯菌检查,生长物做涂片镜检,不得有杂菌。
3.3.5 菌型检查
每亚批疫苗应用硫堇培养基(或纸片法)及硫化氢反应做菌型鉴别检查,应呈牛布氏菌的培养特性。
3.3.6 浓度测定
按“中国细菌浊度标准”测定浓度,每1次人用剂量应含菌数9.0×10〈9〉~1.0×10〈10〉。
3.3.7 活菌数测定及菌落变异检查
每亚批取3瓶,加生理氯化钠溶液复溶混匀后比浊。将菌液浓度稀释为含菌1.0×10〈3〉/ml接种5个平皿,每个平皿接种0.1ml。用涂菌棒涂匀后置35~37℃培养4~5天,计算活菌数,每1次人用剂量含活菌数应大于5×10〈9〉;同时用结晶紫菌落染色检查,菌落变异率不得超过10%。
3.3.8 效力测定
取每5批疫苗中的首批进行效力测定。将复溶后的本品用灭菌生理氯化钠溶液稀释成含菌5.0×10〈8〉/ml菌悬液。取体重300~350g豚鼠10只,每只皮下注射1ml。经25~30天后,每只豚鼠皮下攻击羊型强毒布氏菌10MID或20MID。同时用3只豚鼠作对照,于皮下注射1MID。各组动物于注射毒菌悬液后25~30天解剖,取鼠腹股沟淋巴结、腹主动脉旁淋巴结、肝及脾,分别接种肝琼脂中管斜面培养基,于37℃培养10天。如免疫动物组织之培养物有布氏菌生长,需用硫堇培养基(亦可用纸片法)和硫化氢反应做菌型鉴别试验。对照绀3只豚鼠都必须发生全身感染,即肝脏或脾脏应分离出羊型毒菌。攻击10MLD时,10只免疫豚鼠中不应有3只以上分离出羊型毒菌;攻击20MID时,10只免疫豚鼠中不应有4只以上分离出羊型毒菌。
3.3.9 特异性毒性试验
每亚批取3瓶,用体重18~20g小鼠5只,每只皮下注射含菌1.0×lO〈9〉/ml的菌悬液0.5ml。观察7天不应有死亡,如有死亡应复试一次,仍有死亡.为不合格。
3.3.10 稀释剂
稀释剂为氯化钠注射液。
4 保存、运输及有效期
于2~8℃避光保存和运输。自活菌数测定合格之日起有效期为1年。
5 使用说明
皮上划痕人用布氏菌活疫苗使用说明
【药品名称】
通用名称:皮上划痕人用布氏菌活疫苗
英文名称:Brucellosis Vaccine(Live)for Percutane OUS Scarification
汉语拼音:Pishang Huahen Renyong Bushijun Huoyimiao
【成分和性状】本品系用布氏菌的弱毒菌株经培养、收集菌体加入稳定剂后冻干制成。为乳白色疏松体,复溶后为均匀悬液。
【接种对象】与布氏菌病传染源有密切接触者,每年应免疫一次。布氏菌素反应阳性者可不予接种。
【作用与用途】接种本疫苗后,可使机体产生免疫应答。用于预防布氏菌病。
【规格】每瓶10次人用剂苗。每1次人用剂量含闲数为9.0×10〈9〉~10.0×10〈9〉。
【用法用量】(1)每瓶加入0.5ml氯化钠注射液,复溶后的疫苗应在3小时内用完,剩余的疫苗应废弃。
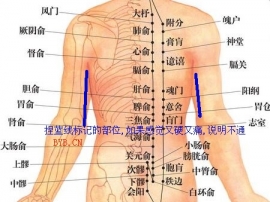
(2)上臂外侧三角肌上部附着处皮上划痕接种。在接种部位滴加疫苗,每1次人用剂量0.05ml,再用消毒针划痕。划痕长度为1~1.5cm,应以划破表皮微见血迹为宜。划痕处用针涂压10余次,使菌液充分进入划痕内。接种后局部应裸露至少5分钟。
(3)10岁以下儿童及复种者疫苗滴于一处划1个“井”字,10岁以上初种者疫苗滴于两处划2个“井”字,间隔2~3cm。
【不良反应】接种后局部反应轻微,少数人划痕处会出现轻度浸润,一般不影响活动。个别人体温稍有增高,一般可自行消退。如因使用途径错误,出现类似急性布氏菌病症状者,要按急性布氏菌病进行彻底治疗。
【禁忌】(1)患严重疾病、免疫缺陷症及接受免疫抑制剂治疗者。
(2)妊娠期及6个月内的哺乳期妇女。
【注意事项】(1)本品仅供皮上划痕用,严禁注射!
(2)开启疫苗瓶和接种时,切勿使消毒剂接触疫苗。
(3)疫苗瓶有裂纹或标签不清者,均不得使用。
【贮藏】于2~8℃避光保存和运输。
【包装】
【有效期】1年。
【执行标准】
【批准文号】
【生产企业】
企业名称:
生产地址:
邮政编码:
电话号码:
传真号码:
网 址: